Une rencontre inespérée
Une rencontre inespérée
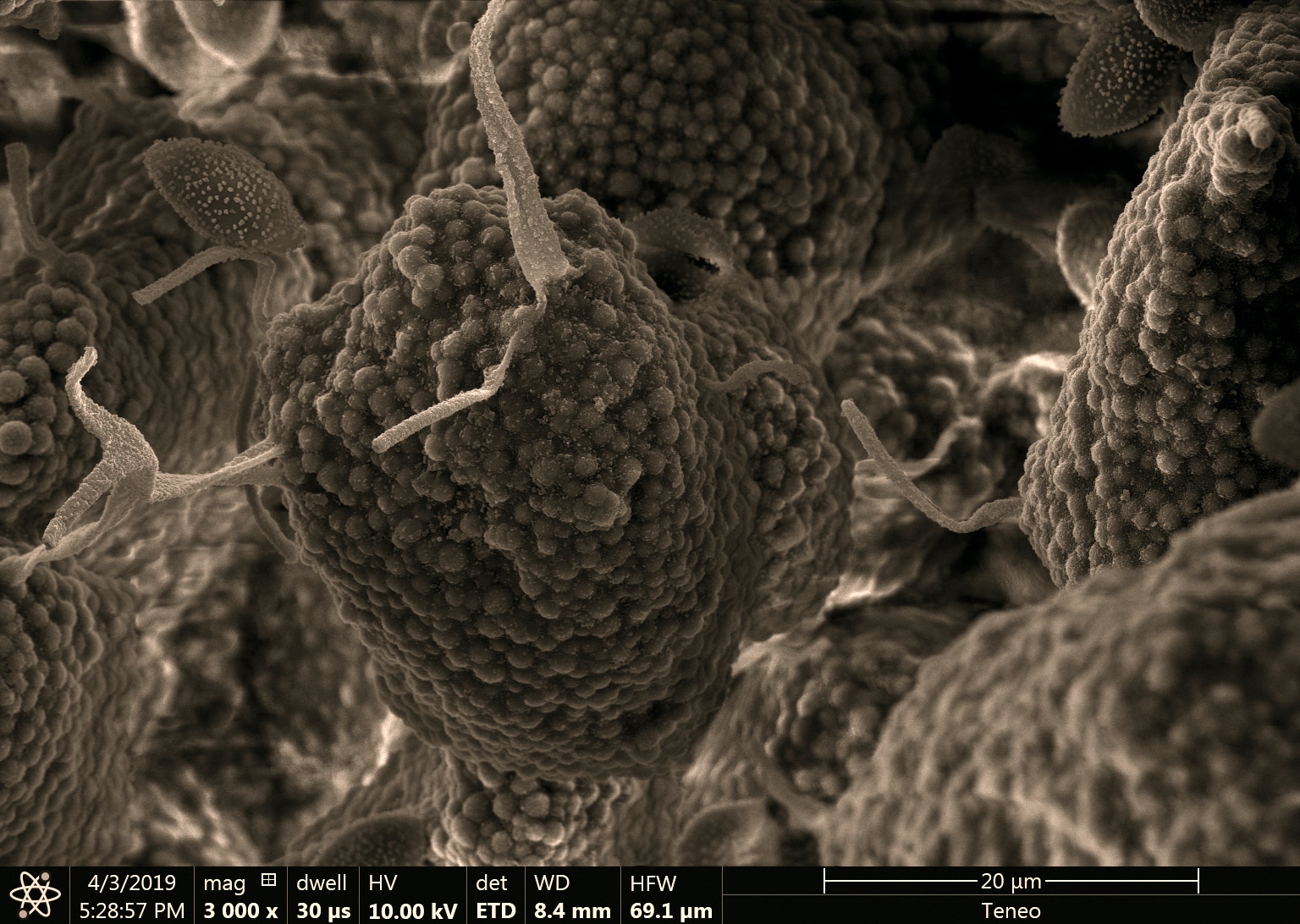
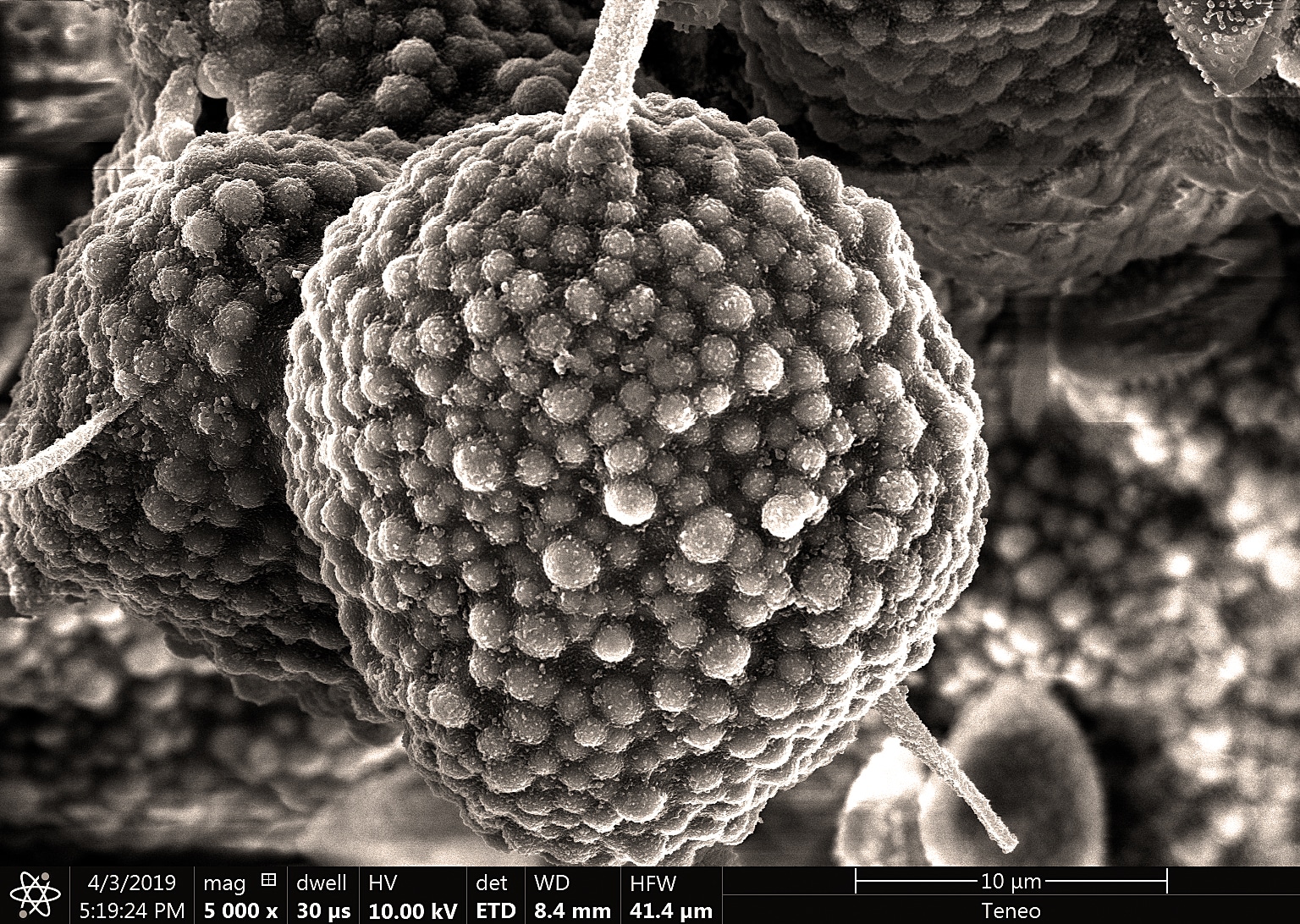
Une nouvelle espèce : le Leucocoprinus griseoflocosus Lagardère & Eyssart.
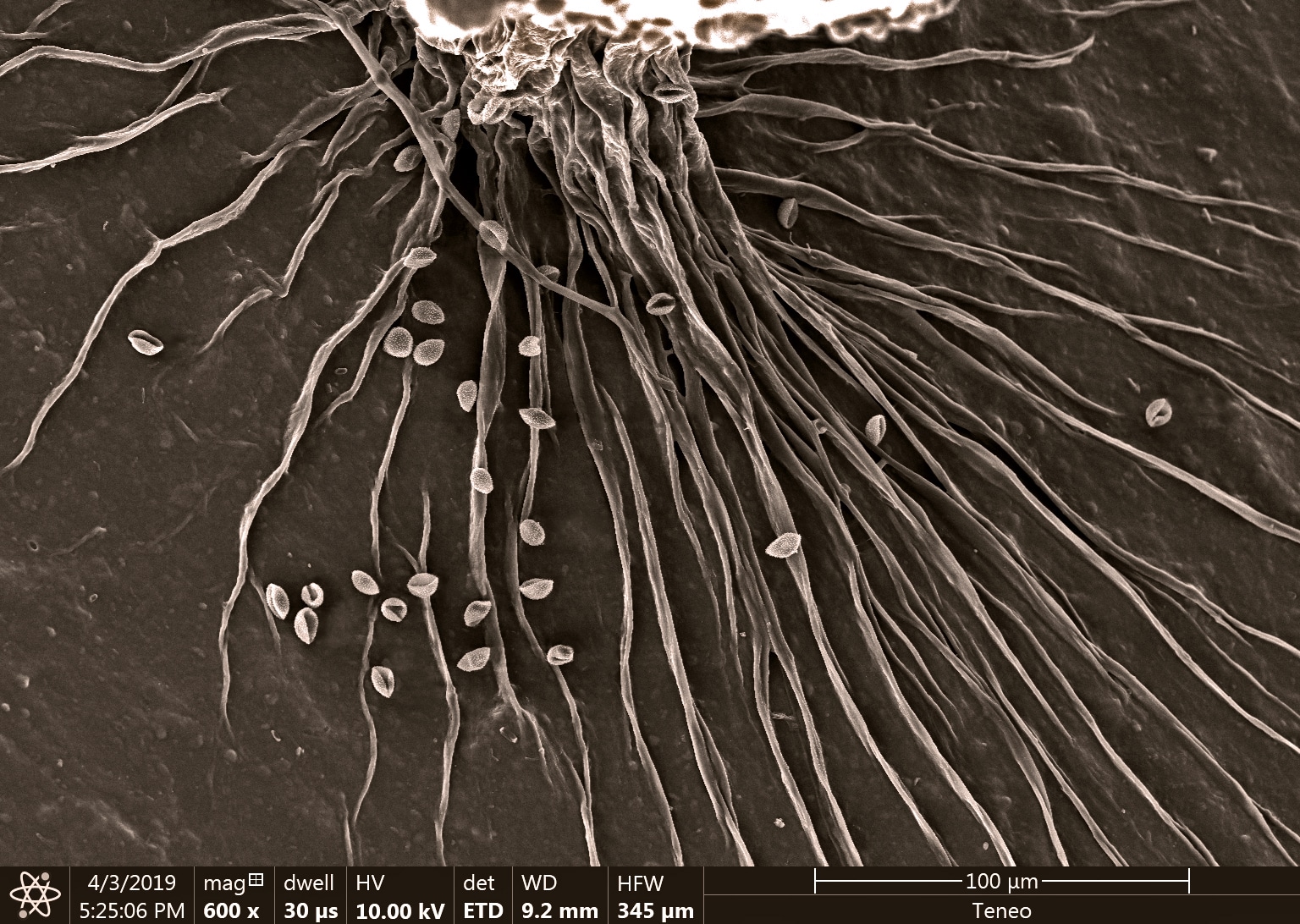
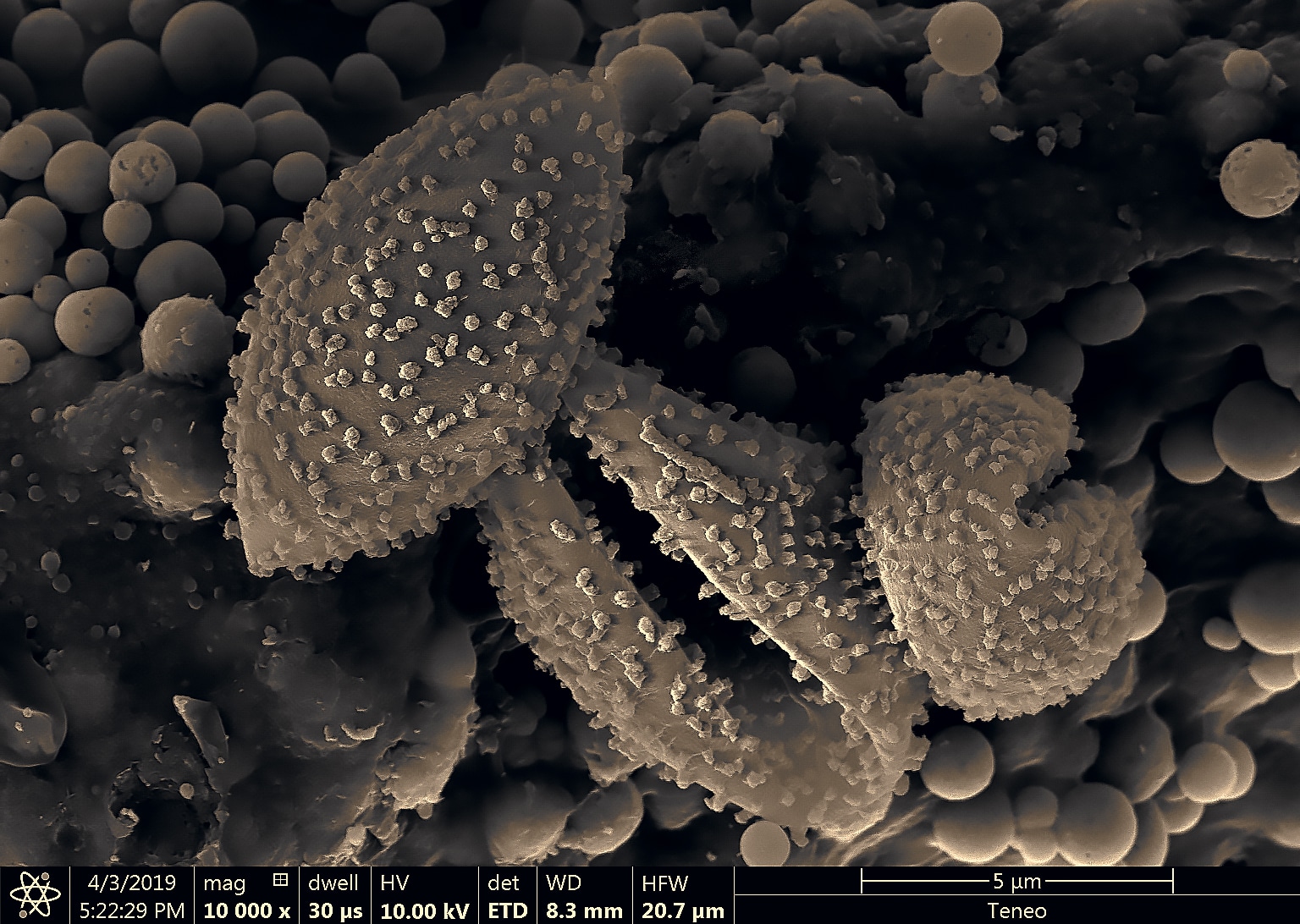
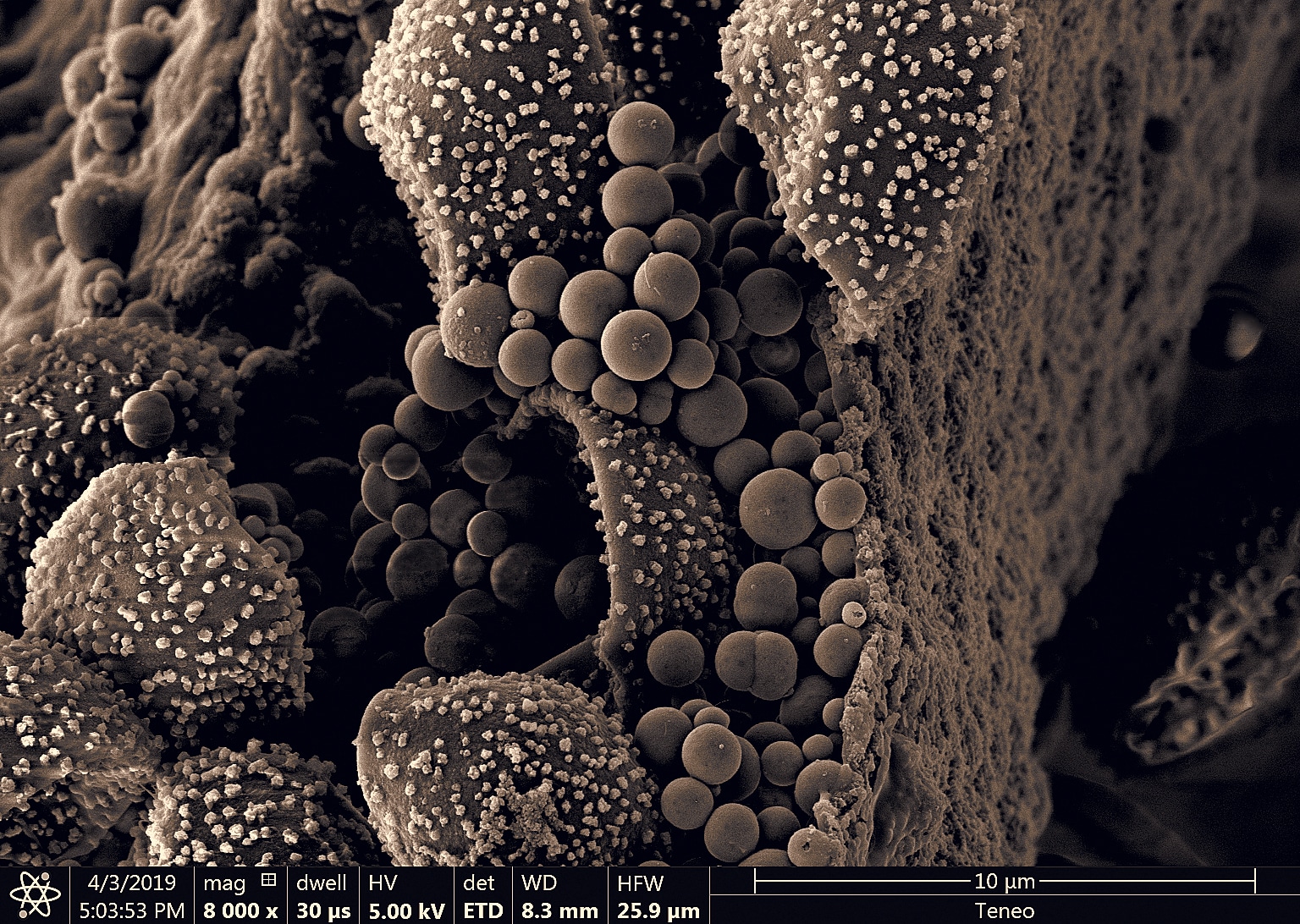
Le myxomycète cobaye : un craterium sp. avec son capillitium (son réservoir à spore) en forme de coupe.
Article initialement publié dans le bulletin de la SMP 2017 et celui de la SMF 2018
Introduction
Juillet 2017, un mois à faibles précipitations pour une année particulièrement sèche dans le sud-ouest de la France. À l’occasion de mes congés, j’ai l’habitude de parcourir landes et forêts en compagnie de mon père à la recherche de champignons, principaux sujets de mon activité de photographe naturaliste, membre de la SMP.
Au fond d’une souche, un groupe de quelques champignons blancs attirent l’attention. Pas plus grands que des Hemimycena, famille commune repérée alentours, ils ont quelques différences notables à commencer par leur habitat et plusieurs détails morphologiques comme la présence d’un anneau et le chapeau floconneux. Je prends soin de prendre quelques photos détaillant leur structure.
De retour au domicile et après une première recherche d’identification infructueuse dans mes ouvrages, une première série de photographies est postée sur Internet afin de solliciter l’aide de la communauté des mycologues connectés. Piqué de curiosité pour ce fragile et inhabituel champignon qu’il identifie dans la famille des Leucocoprinus, Guillaume Eyssartier y répond et me propose une étude approfondie des spécimens observés.
Je retourne sur place et complète ma prise de vues de l’espèce, prélève plusieurs spécimens et note plus attentivement son biotope :
Habitat et récolte
France, département des Landes, commune d’Arengosse, lieu-dit du Mouréou, dans une forêt mixte à tendance feuillue, formée sur un sol à affleurements argileux dans une lande acidophile, le 30 juillet 2017, holotype GE 17.001 (PC) ; l’ensemble des échantillons (une vingtaine) a été trouvé dans les cavités d’un tronc d’aulne (Alnus glutinosa) fortement dégradé, le long d’un mince ruisseau en voie de tarissement ; une deuxième station a été trouvée entre 100 et 200 m plus loin, en remontant le lit du cours d’eau, toujours sur aulne et encore dans la cavité d’un tronc particulièrement pourri.
Les exemplaires sont séchés et envoyés à Guillaume Eyssartier pour une étude approfondie.
Voici la description macroscopique issue de son étude :
Description macroscopique
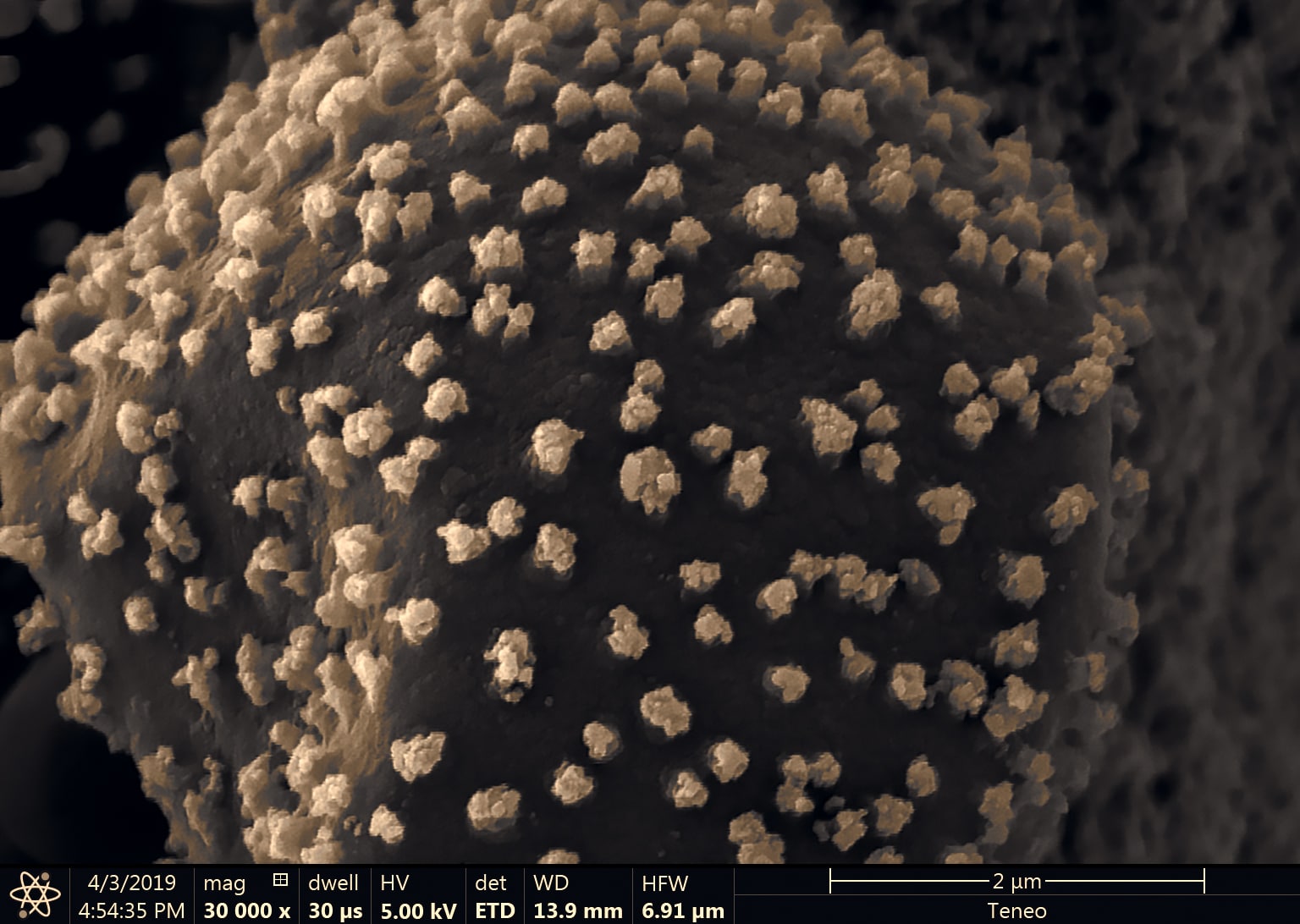
Chapeau mesurant au plus 1 cm de diamètre à pleine maturité, vite plan-convexe ou conico-convexe avec un mamelon très émoussé, blanc ou grisâtre très pâle, mais couvert par un abondant voile farineux gris perle ou de gris-lilas pâle, recouvrant la quasi-totalité de la surface chez les boutons, puis formant un élégant revêtement de petits flocons régulièrement répartis chez les adultes ; les exemplaires vieillissant tendent à devenir ochracés ; marge délicatement striée-cannelée sur quelques millimètres. Lames blanches, libres, plutôt serrées, à arête fortement givrée-poudrée par les cystides émergentes. Pied mesurant 0,5-1,5 × 0,1-0,2 cm, un peu élargi à la base, blanc, pruineux, portant un mince anneau ascendant membraneux et blanc, délicatement teinté de gris au bord. Chair insignifiante, blanche ; odeur faible, saveur non testée.
À partir de mes spécimens séchés, Guillaume Eyssartier procède à l’étude des spores (un des éléments indispensables à l’identification) et de certains tissus comme les restes de voile formant des flocons gris sur le chapeau. Les résultats permettent de confirmer leur rattachement aux groupes des Leucocoprinus proche des lépiotes et des coprins et plus précisément de placer l’espèce vers la section des denudati.
L’enquête se poursuit
Pour plus de certitudes, il envoie un exemplaire du champignon à un laboratoire chargé d’effectuer un séquençage biomoléculaire. Ce dernier renvoi le BLAST (la recherche d’un séquençage comparatif avec les séquences des espèces déjà inventoriées), les résultats donnent au mieux 95% d’analogie avec une petite espèce proche identifiée en Amérique du Nord mais dont les aspects macroscopiques sont suffisamment différents pour être écartés.
Enfin, M. Eyssartier remonte les ouvrages précédent à la recherche d’une possible trace de l’espèce. Et en 1940, deux mycologues anglais ont décrit une espèce très proche Leucocoprinus cygnea, entièrement blanche flocons du voile y compris.
C’est donc forts de toutes ces conclusions et, en ayant pris en compte la spécificité grise des flocons des spécimens, que cette espèce trouvée sur la commune d’Arengosse est décrite comme nouvelle espèce sous le nom de Leucocoprinus griseoflocosus (de flocons gris).
Les exemplaires étudiés ont été inventoriés dans les collections du Muséum National d’Histoire Naturelles à Paris pour y être conservés.
Confirmation en guise de conclusion
En guise de conclusion : un an plus tard, le 19 octobre 2018 et toujours dans les Landes (40), une deuxième station de ce champignon a été découverte par Michel Pié mais, cette fois, dans le secteur de Mimizan, au nord de l’étang d’Aureilhan. Cette station comprenait de très nombreux spécimens sur du bois, là encore, très dégradé. L’étude microscopique des spécimens a été confiée à plusieurs membres qui ont bien confirmés être en présence du Leucocoprinus griseoflocosus.